Le savon est-il un acide ou une base et comment ça marche ?
Qu'est-ce que le savon ?
En chimie, savon est un sel d'un acide gras . Les savons sont principalement utilisés pour lavage , baignade , et nettoyage . Les savons nettoyants sont obtenus en traitant des huiles et des graisses végétales ou animales avec un alcalin solution. Les graisses et les huiles sont composées de triglycérides ; trois molécules de acides gras sont attachés à une seule molécule de glycérol . La solution alcaline, souvent appelée lessive (bien que le terme « savon à lessive » fasse presque exclusivement référence aux savons fabriqués avec hydroxyde de sodium ), provoque un réaction chimique connu sous le nom saponification . Dans cette réaction, les graisses triglycérides sont d'abord hydrolysées en acides gras libres, puis ceux-ci se combinent avec l'alcali pour former du savon brut, un amalgame de divers sels de savon, un excès de graisse ou d'alcali, de l'eau et sont libérés. glycérol (glycérine). La glycérine est un sous-produit utile, qui peut être laissé dans le savon comme agent adoucissant ou isolé pour d'autres utilisations.
Comment fonctionne le savon ?
Le savon est un excellent nettoyant en raison de sa capacité à agir comme agent émulsifiant. Un émulsifiant est capable de disperser un liquide dans un autre liquide non miscible. Cela signifie que même si l'huile (qui attire la saleté) ne se mélange pas naturellement à l'eau, le savon peut suspendre l'huile/la saleté de manière à pouvoir l'éliminer.
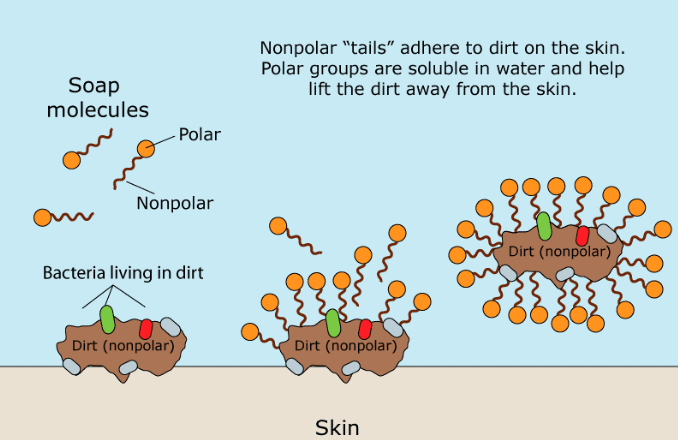
La partie organique du Savon Naturel est une molécule polaire chargée négativement. Son groupe carboxylate hydrophile (qui aime l'eau) (-CO2) interagit avec les molécules d'eau via des interactions ion-dipôle et des liaisons hydrogène. La partie hydrophobe (craignant l’eau) d’une molécule de savon, sa longue chaîne d’hydrocarbures non polaires, n’interagit pas avec les molécules d’eau. Les chaînes d'hydrocarbures sont attirées les unes vers les autres par les forces de dispersion et se regroupent, formant des structures appelées micelles. Dans ces micelles, les groupes carboxylates forment une surface sphérique chargée négativement, avec les chaînes hydrocarbonées à l'intérieur de la sphère. Parce qu'elles sont chargées négativement, les micelles de savon se repoussent et restent dispersées dans l'eau.
La graisse et l'huile sont apolaires et insolubles dans l'eau. Lorsque du savon et des huiles sales sont mélangés, la partie hydrocarbure non polaire des micelles brise les molécules d'huile non polaires. Un autre type de micelle se forme alors, avec des molécules salissantes non polaires au centre. Ainsi, la graisse et l'huile ainsi que la « saleté » qui y est attachée sont capturées à l'intérieur de la micelle et peuvent être rincées.
Le savon est-il un acide ou une base ?
Le savon n’est pas complètement un acide ou une base, c’est un sel basique. C'est une combinaison d'acide faible et de base forte. Lorsqu’un acide et une base sont combinés en une certaine quantité, ils produisent du sel et de l’eau. Et lorsque le sel a une base plus forte dans sa combinaison, il montre une nature basique.
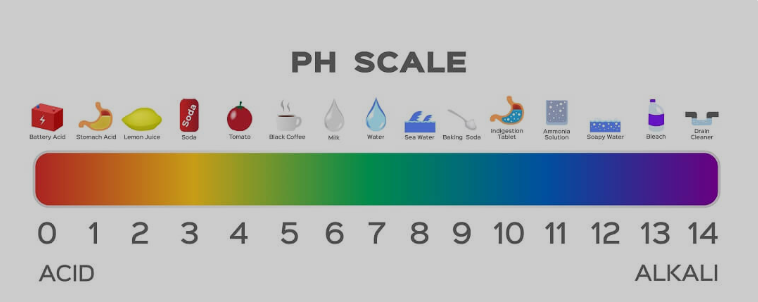
Le savon est-il un acide/base fort ou faible ?
Le savon a une nature basique faible. Bien que des bases fortes soient utilisées lors de la fabrication des savons, les acides faibles utilisés dans la réaction neutralisent les effets dans une certaine mesure. Lorsque vous utilisez une bandelette de pH pour mesurer, la plupart des savons affichent un pH de 9 à 10. Alors que les bases fortes sont comprises entre 12 et 14 sur l'échelle de pH.