Quand le savon a-t-il été inventé, dis-toi
Qu’est-ce que le savon, officiellement ?
Une grande partie de la confusion avec la définition officielle se produit entre le vrai savon et des nettoyants synthétiques – ce que la FDA appelle des « détergents ». Le vrai savon, ou savon ordinaire, est défini comme la « combinaison de graisses ou d’huiles avec un alcali, comme la lessive ». Beaucoup de ces barres sur les étagères, et beaucoup de ces bouteilles à pompe, ne sont pas du tout du savon, mais un mélange de produits synthétiques, dont beaucoup sont inclus pour compenser la nature essentielle des détergents qui décapent la peau.
La FDA ne fait aucune distinction entre le savon à base de graisses végétales et le savon à base de suif. Ils ne tentent pas de définir le savon biologique. Il y a une tâche simple. Même la réglementation du savon relève d’une autre agence gouvernementale, la Consumer Products Safety Commission. Pourtant, ce ne sont pas seulement les ingrédients qui déterminent si un produit relève de la définition réglementaire du savon. Il y a deux autres variables à considérer. Voici une définition pratique en trois points :
- Ingrédients. Pour être réglementé comme du savon, un produit doit être composé principalement de « sels alcalins d’acides gras », c’est-à-dire ce que vous obtenez lorsque vous combinez des acides gras avec de la lessive.
- Comment ça nettoie. Les « sels alcalins d’acides gras » doivent être le seul ingrédient qui exerce une action nettoyante. Si l’on ajoute des matières synthétiques, le produit n’est plus du savon, mais un cosmétique.
- Son utilisation prévue. Pour être réglementé comme du savon, un produit doit être étiqueté et commercialisé uniquement comme du savon. Si son intention est d’hydrater la peau, de désodoriser la peau ou de lui donner une odeur agréable, ce n’est plus du savon, mais un cosmétique. S’il est destiné à traiter l’eczéma ou à prévenir des maladies en tuant les germes, ce n’est plus du savon. C'est officiellement une drogue.

Quand le savon a-t-il été inventé
Les archives montrent que le savon a été produit dès 2800 avant JC par les anciens Babyloniens, mais le savon est devenu particulièrement populaire à l'époque victorienne, lorsque la production de masse est devenue possible après la révolution industrielle. Ceci, combiné à une compréhension croissante des pratiques sanitaires et à la publicité encourageant le bain avec du savon, a permis à l'humble pain de savon de devenir rapidement un objet domestique essentiel.

Quelle est la formule du savon
Depuis des siècles, les humains connaissent la recette de base du savon : il s’agit d’une réaction entre des graisses et une base solide. La formule chimique exacte est C17H35COO- plus un cation métallique, Na+ ou K+. La molécule finale s’appelle le stéarate de sodium et est un type de sel. Selon le cation métallique, les savons sont soit des sels de potassium, soit des sels de sodium disposés sous forme d'acides carboxyliques à longue chaîne.
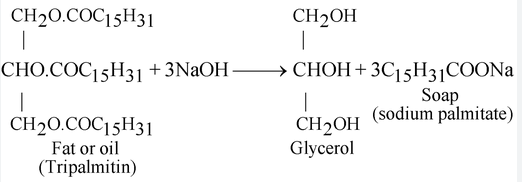
Généralement, la formation de ces chaînes implique de combiner l'hydroxyde de potassium avec une graisse animale ou végétale, ou parfois avec l'acide acétique . Une molécule de savon fait deux choses : elle se lie à la fois à l’eau et aux débris. Cela est dû à ses composants hydrophiles, ou « qui aiment l’eau », et hydrophobes, ou « craignant l’eau ». Une molécule de savon possède une « tête » anionique hydrophile et une « queue » hydrophobe constituée d’hydrocarbures. La tête des molécules est attirée et se dissout dans l'eau, tandis que la queue d'hydrocarbure est attirée par la saleté et la graisse et repoussée par l'eau.
Le savon est également un tensioactif : il réduit la tension superficielle de l’eau. L'eau a une forte tension superficielle , qui fait perler les gouttes sur une variété de surfaces allant du métal au tissu. Cela ralentit le processus de mouillage de l’eau et inhibe sa capacité à nettoyer. Parce que les savons diminuent la tension superficielle de l’eau, celle-ci peut se propager et se mouiller plus facilement. De plus, les tensioactifs détachent et émulsionnent la saleté et les débris, les dispersant dans l’eau et leur permettant d’être rincés.
Aujourd'hui, le processus de fabrication du savon consiste le plus souvent à faire réagir un acide organique avec des produits chimiques alcalins comme l'hydroxyde de potassium ou l'hydroxyde de sodium. Industriellement, la base de soude caustique la plus souvent utilisée est l'hydroxyde de sodium, également appelé lessive. La principale différence entre les savons de potassium et de sodium est la consistance : généralement, le potassium donne un savon plus doux et plus soluble dans l’eau que le sodium.
Comment fonctionne le savon ?
Le savon est capable de nettoyer les mains et la vaisselle grâce à une chimie assez astucieuse. Les molécules de savon ont à une extrémité ce qu’on appelle un sel polaire, qui est hydrophile ou attiré par l’eau. L'autre extrémité de la molécule est une chaîne non polaire d'acides gras ou d'hydrocarbures, qui est hydrophobe, ce qui signifie qu'elle est repoussée par l'eau mais attirée par la graisse et d'autres substances huileuses. Lorsque vous vous lavez les mains, le savon forme quelque chose comme un pont moléculaire entre l'eau et les huiles sales et chargées de germes sur vos mains, se fixant à la fois aux huiles et à l'eau et éliminant la saleté. Les savons peuvent également se lier aux membranes grasses à l'extérieur des bactéries et de certains virus, éliminant les agents infectieux et même les brisant. Une fois que la saleté huileuse et les germes sont retirés de vos mains, les molécules de savon les entourent complètement et forment de minuscules amas, appelés micelles, qui les empêchent de s'attacher à quoi que ce soit d'autre pendant qu'elles s'écoulent dans les égouts.